Металлы главной подгруппа III группы
Групповое сходство элементов обусловлено наличием 3-х электронов на внешнем электронном слое и заключается в следующем:
- наиболее характерная валентность III (искл. Ti)
- наиболее характерная степень окисления +3
- металличный характер (искл. В)
Общая характеристика подгруппы
5В 1s22s22p1
13Аl [Ne]3s23p1
31Ga[Ar]3d104s24p1
49ln [Kr]4d105s25p1
81Tl [Xe]4f145d106s26p1
С ростом заряда ядра многие важнейшие характеристики элементов изменяются немонотонно, в том числе и атомный радиус. Соответственно, свойства простых веществ, оксидов, гидроксидов и других соединений этих элементов имеют неоднозначный характер изменения. Особенно резко выделяется первый элемент подгруппы - бор, являющийся единственным неметаллом среди s2p1-элементов. Бор проявляет диагональное сходство с элементом главной подгруппы IV группы - кремнием Si.
Алюминий - важнейший элемент подгруппы, также имеет целый ряд специфических особенностей, отличающих его от бора, с одной стороны, и от подгруппы галлия, с другой стороны.
Характеристические соединения
Оксиды |
Гидроксиды |
||||
Формула |
Характер |
Отношение к воде |
Формула |
Характер |
Отношение к воде |
B2O3 |
кислотный |
хорошо растворимый |
H3BO3 |
слабая кислота1-основная |
хорошо растворимая |
Al2O3 |
амфотерный |
не растворимый |
Al(OH)3H3AlO3HAlO2H[Al(OH)4] |
амфотерный |
не растворимый |
Ga2O3 |
амфотерный |
не растворимый |
Ga(OH)3H3GaO3HGaO2 |
амфотерный (идеальный амфолит) |
не растворимый |
In2O3 |
основный со слабыми признаками амфотерности |
не растворимый |
In(OH)3 |
амфотерный (основные свойства преобладают) |
не растворимый |
Tl2O |
основный |
растворимый |
Tl(OH) |
основание (подобен щелочам) |
хорошо растворимый |
Алюминий
13Аl [Ne] 3s23p1
Ar 26.982
1 стабильный изотоп 27Al
ЭО 1.5
E° -1,67 В
Кларк в земной коре 8,8 % по массе, самый распространенный металл. В свободном виде не встречается.
Основная форма нахождения в природе - Аl2O3 (в составе различных силикатов, полевых шпатов и глин). Встречается также в виде двойных солей: KAl(SO4)2, Na3[AlF6] и др.

Физические свойства
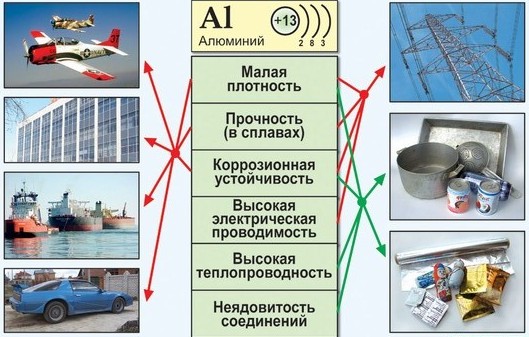
Простое вещество алюминий - лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. По электропроводности занимает 4-е место после Сu, Аg, Аu.
Способы получения
1. Электролиз расплава AlCl3:
2AlCl3 = 2Al + 3Cl2
2. Основной промышленный способ - электролиз расплава Al2O3 (глинозема) в криолите 3NaF • AlF3:
2Al2O3 = 4AI + 3O2
3. Вакуумтермический:
AlCl3 + ЗК = Al + 3KCl
Химические свойства
Аl - очень химически активный металл, однако при обычных условиях ведет себя довольно инертно - имеет высокую температуру воспламенения, со многими веществами реагирует только при высокой температуре; все реакции с участием Al проходят через первоначальный замедленный период. Такое химическое поведение алюминия объясняется наличием на его поверхности очень тонкой, прочной, газо- и водонепроницаемой пленки Al2O3. При нарушении цельности этой пленки AI реагирует со многими веществами как активный восстановитель:
Al0 - Зе- → Аl3+
В подавляющем большинстве соединений атомы алюминия связаны с соседними атомами ионными связями.
a) 4Al + 3O2 = 2Аl2О3
При обычной температуре реакция протекает только на поверхности. После нагревания до температуры воспламенения измельченный Аl сгорает с высоким экзотермичным эффектом.
б) 2Al + 3Cl2 = 2АlСl3 хлорид
2Al + ЗВr2 = 2АlВr3 бромид
2Al + 3I2 = 2AlI3 йодид
Реакция с I2 протекает в присутствии воды. С F2 реакции нет. т. к. в первый же момент образуется прочный поверхностный слой AlF3.
в) 2Al + 3S = Al2S3 сульфид
2Al + N2 = 2AlN нитрид
4Al + ЗС = АlС3 карбид
г) C Н2 алюминий непосредственно не соединяется.
Роль щелочи.
1) растворение оксидной пленки Al2O3;
2) предотвращение образования нерастворимого гидроксида Аl(ОН)3.
2Al + 6Н2O + 2NaOH = 2Na[Al(OH)4] + 3H2↑
Na[Al(OH)4] - тетрагидроксо-алюминат натрия
В отсутствие щелочи алюминий может вытеснять Н2 из воды в следующих условиях:
1) если его поверхность амальгамировать (покрыть ртутью);
2) в вакууме или в среде инертного газа после предварительной очистки поверхности металла от оксидной пленки.
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
При обычной Т реакции не протекают, т. к. происходит пассивирование поверхности Al, связанное с внедрением в нее атомарного или молекулярного кислорода, а также образованием его нерастворимых соединений с Al.
При нагревании реакции протекают довольно активно:
Al + 6HNO3конц. = Al(NO3)3 + 3NO2↑ + 3H2O
8Al + 15H2SO4 конц.= 4Al2(SO4)3 + 3H2S↑ + 12Н2O
Реакция медленно протекает при обычной Т, при нагревании - более быстро.
Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O
8Al + 30HNO3оч.разб = 8Al(NO3)3 + 3NH4NO3 + 92O
Реакции протекают с разбавленными уксусной и лимонной кислотами при нагревании, ускоряются в присутствии NaCl:
Al + 6СН3СООН = 2(СН3СОО)3Al + 3H2↑
2Al + Сr2O3 = 2Cr + Al2O3
Применение алюминия