Кислородные соединения фосфора
Фосфор образует очень большое число различных оксидов и кислот. Среди них наиболее устойчивыми являются оксид фосфора (V) и соответствующая ему ортофосфорная, или фосфорная, кислота H3PO4.
Оксиды фосфора
Р2О3 - оксид фосфора (III)
При обычной температуре - белая воскообразная масса с т. пл. 23,5'С. Очень легко испаряется, имеет неприятный запах, очень ядовит. Существует в виде димеров Р4О6.
Способ получения
Р2О3 образуется при медленном окислении фосфора или при его горении в недостатке кислорода:
4Р + 3О2 = 2Р2О3
Химические свойства
Р2О3 - кислотный оксид
Как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2H3PO3
Но при растворении в горячей воде происходит очень бурная реакция диспропорционирования Р2О3:
2Р2О3 + 6Н2О = РН3 + ЗH3PO4
Взаимодействие Р2О3 со щелочами приводит к образованию солей фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
Р2О3 - очень сильный восстановитель
1. Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
2. Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2H3PO4
Р2О5 - оксид фосфора (V)
При обычной температуре - белая снегоподобная масса, не имеет запаха, существует в виде димеров Р4О10. При соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 - самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Способ получения
Фосфорный ангидрид образуется в результате сжигания фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Химические свойства
Р2О5 - типичный кислотный оксид
Как кислотный оксид Р2О5 взаимодействует:
а) с водой, образуя при этом различные кислоты
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая (дифосфорная)
Р2О5 + ЗН2О = 2H3PO4 ортофосфорная
б) с основными оксидами, образуя фосфаты Р2О5 + ЗВаО = Ва3(PO4)2
в) со щелочами, образуя средние и кислые соли
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2NaH2PO4 + Н2О
Р2О5 - водоотнимающий агент
Фосфорный ангидрид отнимает у других веществ не только гигроскопическую влагу, но и химически связанную воду. Он способен даже дегидратировать оксокислоты:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
Это используется для получения ангидридов кислот.
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, но большое число кислот, в которых он находится в степенях окисления +5, +4, +3, +1. Строение наиболее известных кислот выражается следующими формулами
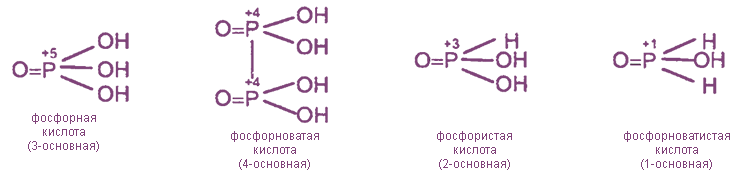
Как видно из этих формул, фосфор во всех случаях образует пять ковалентных связей, т.е. имеет валентность, равную V. В то же время степени окисления фосфора и основность кислот различаются.
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
H3PO4 - фосфористая кислота
Важная особенность фосфористой кислоты обусловлена строением ее молекул. Один из 3-х атомов водорода связан непосредственно с атомом фосфора, поэтому не способен к замещению атомами металла, вследствие чего эта кислота является двухосновной. Формулу фосфористой кислоты записывают с учетом этого факта следующим образом: Н2[НРО3]
Является слабой кислотой.
Способы получения
1. Растворение Р2О3 в воде (см. выше).
2. Гидролиз галогенидов фосфора (III): PCl3 + ЗН2О = Н2[НРО3] + 3HCl
3. Окисление белого фосфора хлором: 2Р + 3Cl2 + 6Н2О = 2Н2[НРО3] + 6HCl
Физические свойства
При обычной температуре H3PO3 - бесцветные кристаллы с т. пл. 74°С, хорошо растворимые в воде.
Химические свойства
Кислотные функции
Фосфористая кислота проявляет все свойства, характерные для класса кислот: взаимодействует с металлами с выделением Н2; с оксидами металлов и со щелочами. При этом образуются одно - и двухзамещенные фосфиты, например:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
Восстановительные свойства
Кислота и ее соли - очень сильные восстановители; они вступают в окислительно-восстановительные реакции как с сильными окислителями (галогены, H2SО4 конц., К2Сr2O2), так и с достаточно слабыми (например, восстанавливают Au, Ag, Pt, Pd из растворов их солей). Фосфористая кислота при этом превращается в фосфорную.
Примеры реакций:
H3PO3 + 2AgNO3 + Н2О = H3PO4 + 2Ag↓ + 2HNO3
H3PO3 + Cl2 + Н2О = H3PO4 + 2HCl
При нагревании в воде Н3РO3 окисляется до H3PO4 с выделением водорода:
H3PO3 + Н2О = H3PO4 + Н2
Восстановительные свойства
Реакция диспропорционирования
При нагревании безводной кислоты происходит диспропорционирование: 4Н3РO3 = ЗН3РO4 + РН3
Фосфиты - соли фосфористой кислоты
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2Р03.
Примеры: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2- 1 анионами HPO3.
Примеры: Na2HPO3, СаHPO3.
Большинство фосфитов плохо растворимы в во-де, хорошо растворяются только фосфиты щелочных металлов и кальция.
Н3РO4 - ортофосфорная кислота
3-основная кислота средней силы. Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4-
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н2РO4- → Н+ + НРO42-
НРO42- → Н+ + РO43-
Физические свойства
При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое (т. пл. 42°'С). Смешивается с водой в любых соотношениях.
Способы получения
Исходным сырьем для промышленного получения Н3РO4 служит природный фосфат Са3(РO4)2:
I. 3-стадийный синтез:
Са3(РO4)2 → Р → Р2O5 → Н3РO4
II. Обменное разложение фосфорита серной кислотой
Са3(РO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4↓
Получаемая по этому способу кислота загрязнена сульфатом кальция.
III. Окисление фосфора азотной кислотой (лабораторный способ):
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
Химические свойства
Н3РO4 проявляет все общие свойства кислот - взаимодействует с активными металлами, с основными оксидами и основаниями, образует соли аммония.
Кислотные функции
Примеры реакций:
2Н3РO4 + 6Na = 2Na3РO4 + 3H2t
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
в) со щелочами, образуя средние и кислые соли
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + NaOH = NaH2PO4 + Н2О
Н3РO4 + NH3 = NH4H2PO4
Н3РO4 + 2NH3 = (NH4)2HPO4
В отличие от аниона NO3- в азотной кислоте, анион РO43- окисляющим действием не обладает.
Качественная реакция на анион РO43-
Реактивом для обнаружения анионов РO43- (а также НРO42- , Н2РO4-) является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра:
ЗАg+ + РO43- = Аg3РO4↓
Образование сложных эфиров
Сложные эфиры нуклеозидов и фосфорной кислоты являются структурными фрагментами природных биополимеров - нуклеиновых кислот.
Фосфатные группы входят также в состав ферментов и витаминов.
Фосфаты. Фосфорные удобрения.
Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
Название |
Анион соли |
Растворимость в воде |
Примеры солей |
Фосфаты |
PO43- |
большинство нерастворимо (кроме фосфатов щелочных Me и аммония) |
Na3РO4; Са3(РO4)2 |
Гидрофосфаты |
HPO42- |
растворимы |
Na2НРO4; СаНРО4 |
Дигидрофосфаты |
Н2РO4- |
очень хорошо растворимы |
NaH2PO4; Са(Н2РO4)2 |
Растворимые соли фосфорной кислоты в водных растворах подвергаются гидролизу.
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
1. Фосфоритная мука - тонкоизмельченный природный фосфат кальция Са3(РO4)2
2. Простой суперфосфат - Са3(РO4)2 + 2H2SO4 = Са(Н2РO4)2 + 2CaSO4
3. Двойной суперфосфат - Са3(РO4)2 + 4Н3РO4 = ЗСа(Н2РO4)2
4. Преципитат - Са(ОН)2 + Н3РO4 = СаНРO4 + 2Н2О
5. Аммофос - NH3 + Н3РO4 = NH4Н2РO4;
2NH3 + Н3РO4 = (NH4)2HРO4
6. Аммофоска - Аммофос + KNO3