Вода
- Пероксид водорода.
Физические и химические свойства
Физические и химические свойства воды определяются химическим, электронным и пространственным строением молекул Н2O.
Атомы Н и О в молекуле Н20 находятся в своих устойчивых степенях окисления, соответственно +1 и -2; поэтому вода не проявляет ярко выраженных окислительных или восстановительных свойств. Обратите внимание: в гидридах металлов водород находится в степени окисления -1.
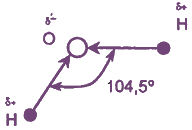
Молекула Н2O имеет угловое строение. Связи Н-O очень полярны. На атоме О существует избыточный отрицательный заряд, на атомах Н - избыточные положительные заряды. 8 целом молекула Н2O является полярной, т.е. диполем. Этим объясняется тот факт, что вода является хорошим растворителем для ионных и полярных веществ.
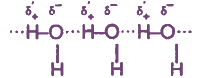
Наличие избыточных зарядов на атомах Н и О, а также неподеленных электронных пар у атомов О обусловливает образование между молекулами воды водородных связей, вследствие чего они объединяются в ассоциаты. Существованием этих ассоциатов объясняются аномально высокие значения т. пл. и т. кип. воды.
Наряду с образованием водородных связей, результатом взаимного влияния молекул Н2O друг на друга является их самоионизация:
в одной молекуле происходит гетеролитический разрыв полярной связи О-Н, и освободившийся протон присоединяется к атому кислорода другой молекулы. Образующийся ион гидроксония Н3О+ по существу является гидратированным ионом водорода Н+ • Н2O, поэтому упрощенно уравнение самоионизации воды записывается так:
Н2O ↔ H+ + OH-
Константа диссоциации воды чрезвычайно мала:
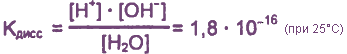
Это свидетельствует о том, что вода очень незначительно диссоциирует на ионы, и поэтому концентрация недиссоциированных молекул Н2O практически постоянна:
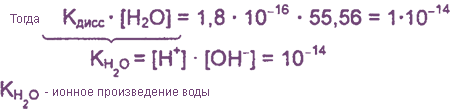
В чистой воде [Н+] = [ОН-] = 10-7 моль/л. Это означает, что вода представляет собой очень слабый амфотерный электролит, не проявляющий в заметной степени ни кислотных, ни основных свойств.
Однако вода оказывает сильное ионизирующее действие на растворенные в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные, ионы гидратируются, связи между ними ослабляются, в результате чего происходит электролитическая диссоциация. Например:
HCl + Н2O - Н3O+ + Сl-
(сильный электролит)
(или без учета гидратации: HCl → Н+ + Сl-)
CH3COOH + H2O ↔ CH3COO- + H+ (слабый электролит)
(или CH3COOH ↔ CH3COO- + H+)
Согласно теории кислот и оснований Брёнстеда-Лоури, в этих процессах вода проявляет свойства основания (акцептор протонов). По той же теории в роли кислоты (донора протонов) вода выступает в реакциях, например, с аммиаком и аминами:
NH3 + H2O ↔ NH4+ + OH-
CH3NH2 + H2O ↔ CH3NH3+ + OH-
Окислительно-восстановительные реакции с участием воды
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н+2О = 2NaOH + H02↑
Ca + 2Н+2О = Ca(OH)2 + H02↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
Mg + 2Н+2О = Mg(OH)2 + H02↑
3Fe + 4Н+2О = Fe2O4 + 4H02↑
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2Al + 6Н+2О + 2NaOH = 2Na[Al(OH)4] + 3H02↑
C + Н+2О = CO + H02↑ («водяной газ»)
2P + 6Н+2О = 2HPO3 + 5H02↑
В присутствии щелочей кремний вытесняет водород из воды:
Si + Н+2О + 2NaOH = Na2SiO3 + 2H02↑
NaH + Н+2 O = NaOH + H02↑
CaH2 + 2Н+2О = Ca(OH)2 + 2H02↑
CO + Н+2O = CO2 + H02
2CH4 + O2 + 2Н+2 O = 2CO2 + 6H02
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2]2-. В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
2F2 + 2Н2O-2 = O02 + 4HF
или:
2F2 + Н2O-2 = O+2F2 + 2HF
Н2O-2 + O• = Н2O-2
При высокой Т происходит обратимая реакция
2Cl2 + 2Н2O-2 = O02 + 4HCl
III. Реакции внутримолекулярного окисления - восстановления воды.
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
2Н+2O-2 = 2H02↑ + O02↑
Термическое разложение - процесс обратимый; степень термического разложения воды невелика.
Реакции гидратации
II. Гидратация оксидов
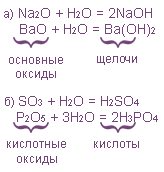
III. Гидратация органических соединений, содержащих кратные связи
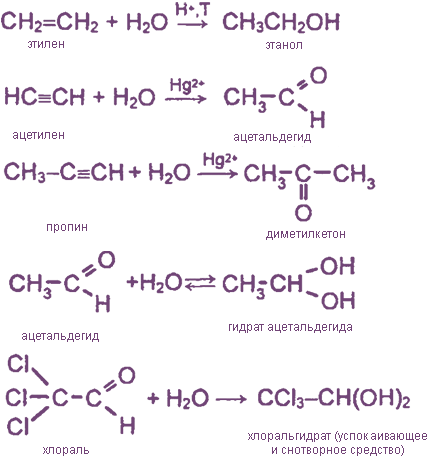
Реакции гидролиза
Обратимый гидролиз:
а) по катиону соли
Fe3+ + Н2O = FeOH2+ + Н+; (кислая среда. рН < 7)
б) по аниону соли
СО32- + Н2O = НСО3- + ОН-; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH4+ + СН3СОО- + Н2O = NH4OH + СН3СООН (среда, близкая к нейтральной)
Необратимый гидролиз:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Al4C3 + 12Н2O = 4Аl(ОН)3↓ + 3CH4↑ нетан
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑ ацетилен
Mg2Si + 4Н2O = 2Mg(OH)2↓ + SiH4↑ силан
Ca3N2 + 6Н2O = ЗСа(ОН)2 + 2NH3↑ аммиак
Cu3P2 + 6Н2O = ЗСu(ОН)2 + 2РН3↑ фосфин
Cl2 + Н2O = HCl + HClO
Вr2 + Н2O = НВr + НВrО
Классы органических веществ |
Продукты гидролиза (органические) |
Галогеналканы (алкилгалогениды) |
Спирты |
Арилгалогениды |
Фенолы |
Дигалогеналканы |
Альдегиды или кетоны |
Алкоголяты металлов |
Спирты |
Галогенангидриды карбоновых кислот |
Карбоновые кислоты |
Ангидриды карбоновых кислот |
Карбоновые кислоты |
Сложные зфиры карбоновых кислот |
Карбоновые кислоты и спирты |
Жиры |
Глицерин и высшие карбоновые кислоты |
Ди- и полисахариды |
Моносахариды |
Пептиды и белки |
α-Аминокислоты |
Нуклеиновые кислоты |
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза) |